Bài tập 4. Cho cân bằng hoá học:
N2(g) + 3H2(g) 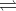 2NH3(g) $\Delta _{r}H_{298}^{o}$ = - 92kJ
2NH3(g) $\Delta _{r}H_{298}^{o}$ = - 92kJ
Cân bằng chuyển dịch theo chiều nào (có giải thích) khi:
a) tăng nhiệt độ.
b) tách ammonia ra khỏi hỗn hợp phản ứng.
c) giảm thể tích của hệ phản ứng.
Bài Làm:
a) Phản ứng có $\Delta _{r}H_{298}^{o}$ < 0 --> phản ứng tỏa nhiệt
khi tăng nhiệt độ thì phản ứng xảy ra theo phản ứng thu nhiệt (chiều nghịch)
b) Khi tách Ammonia ra khỏi hỗn hợp phản ứng thì cân bằng xảy ra theo chiều làm tăng chất sản phẩm --> cân bằng xảy ra theo chiều thuận
c) Giảm thể tích của hệ phản ứng --> giảm số phân tử khí --> cân bằng chuyển dịch theo tăng số phân tử khí (chiều nghịch)




