I. Cấu trúc electron bền vững của khí hiếm
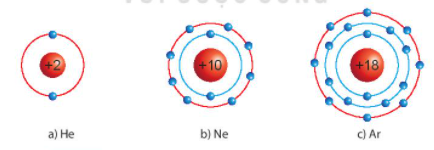
Câu hỏi . Quan sát hình 6.1, so sánh số electron lớp ngoài cùng của He, Ne và Ar
Hướng dẫn giải :
Số electron lớp ngoài cùng của He ít hơn Ne và Ar và số lớp electron lớp ngoài cùng của Ne và Ar bằng nhau.
II. Liên kết ion
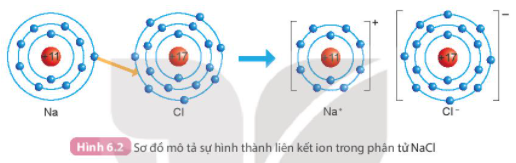
Câu hỏi 1. Quan sát Hình 6.2 và so sánh số electron ở lớp ngoài cùng của nguyên tử Na, Cl với ion Na+, Cl-
Hướng dẫn giải :
- Số electron lớp ngoài cùng của nguyên tử Na nhiều hơn số electron lớp ngoài cùng của ion Na+
- Số electron lớp ngoài cùng của nguyên tử Cl ít hơn số electron lớp ngoài cùng của ion Cl-
Câu hỏi 2. Cho sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium oxide như sau:
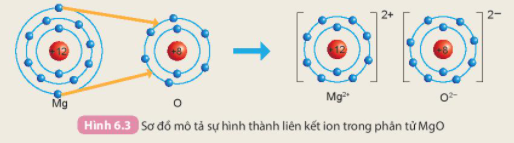
Hãy cho biết nguyên tử Mg đã nhường hay nhận bao nhiêu electron.
Hướng dẫn giải :
Nguyên tử Mg đã nhường 2 electron
Bài tập & Lời giải
III. Liên kết cộng hóa trị
1. Liên kết cộng hóa trị trong phân tử đơn chất
Câu hỏi 1. Quan sát Hình 6.4 và Hình 6.5, cho biết số electron lớp ngoài cùng của H và O trước và sau khi tạo thành liên kết cộng hóa trị
Xem lời giải
Câu hỏi 2. Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử khí chlorine, khí nitrogen.
Xem lời giải
2. Liên kết cộng hóa trị trong phân tử hợp chất
Câu hỏi 1. Quan sát Hình 6.6 và cho biết khi nguyên tử O liên kết với hai nguyên tử H theo cách dùng chung electron thì lớp vỏ của nguyên tử oxygen giống với lớp vỏ của nguyên tử khí hiếm nào?
Xem lời giải
Câu hỏi 2. Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide, ammonia (gồm một nguyên tử N liên kết với ba nguyên tử H)