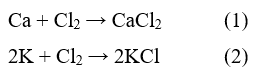16.5. Cho hai phản ứng có phương trình hóa học như sau:
2O3 (g) → 3O2 (g) (1)
2HOF (g) → 2HF + O2 (g) (2)
a) Viết biểu thức tốc độ trung bình (theo cả các chất phản ứng và chất sản phẩm) của hai phản ứng trên.
b) Trong phản ứng (1), nếu $\frac{\Delta C_{O_{2}}}{\Delta t}$ = 1,5×10−4molL−1s−1 thì $\frac{\Delta C_{O_{3}}}{\Delta t}$ bằng bao nhiêu?
Bài Làm:
a) Phản ứng (1): $\overline{\upsilon }=-\frac{1}{2}.\frac{\Delta C_{O_{3}}}{\Delta t}=\frac{1}{3}.\frac{\Delta C_{O_{2}}}{\Delta t}$
Phản ứng (2): $\overline{\upsilon }=-\frac{1}{2}.\frac{\Delta C_{HOF}}{\Delta t}=\frac{1}{2}.\frac{\Delta C_{HF}}{\Delta t}=\frac{\Delta C_{O_{2}}}{\Delta t}$
b) Ta có:
$\overline{\upsilon }=-\frac{1}{2}.\frac{\Delta C_{O_{3}}}{\Delta t}=\frac{1}{3}.\frac{\Delta C_{O_{2}}}{\Delta t}$
→ $\frac{\Delta C_{O_{3}}}{\Delta t}= -\frac{2}{3}.\frac{\Delta C_{O_{2}}}{\Delta t} = -\frac{2}{3}.1,5 . 10^{-4}$ = −1,0×10−4(molL−1s−1)